Сравниваем p-элементы 2 и 3 периодов



Напомним, что уникальность р-элементов 2 периода заключается в том, что у бора (В), углерода (С), неона (N), кислорода (O), фтора (F) дейтронные р-орбитали могут менять свое положение, перемещаясь по р-орбите. А это означает, что у этих р-элементов атомные ядра способны к некоторой деформации.
Жесткой конструкцией обладает лишь атомное ядро последнего р-элемент 2-го периода – неона (Ne), у которого сформирован стабильный «каркас» из шести дейтронных р-орбиталей (трех верхних и трех нижних).
Он-то и станет матрицей, в соответствии с которой р-элементы 3-его (и последующих) периодов будут строить свои дейтронные р-орбитали.
Ну а теперь переходим к вопросу: почему соединение кислорода с водородом – Н2О, вода, а соединение серы с водородом – Н2S, газ? И это притом, что атом кислорода в два раза легче атома серы.
Электронные формулы кислорода и серы:
О; 1s2, 2s2, 2р4
S; 1s2, 2s2, 2р6, 3s2,3р4
Напомним, что электронная формула раскрывает строение не только электронных оболочек, но и атомного ядра (см. Нижнее меню. Полярная модель атома Доказательства). Отличие конструкций атомов О и S показано на схеме.
Рассмотрим это отличие более детально…
В атоме кислорода (О) четыре дейтронные р-орбитали: две расположены на верхней ядерной р-орбите и две – на нижней. См «Уникальность p-элементов 2 периода» Нижнее меню. Полярная модель атома Доказательства.
Своеобразное расположение р-орбиталей делает атом кислорода конструкцией симметричной (насколько это возможно для полярной модели атома), а значит, стабильной.
В ядре серы (S) два уровня р-орбиталей.
Первый уровень – это жесткий «каркас», из шести дейтронных р-орбиталей (2р6) – трех верхних и трех нижних.
В соответствии с этим жестким «каркасом» и будут формироваться четыре дейтронных р-орбитали (3р4) второго уровня.
В результате атом S окажется жесткой асимметричной конструкцией. Напомним, что атом О из-за способности р-орбиталей перемещаться по р-орбитам жесткой конструкцией не является.
А теперь рассмотрим соединения: Н2О, и Н2S.
В разделе «Молекула воды, какая она?» (см. Нижнее меню Полярная модель атома Доказательства), было выяснено, что Н2О – прочная, симметричная, а значит, стабильная структура, в которой атом кислорода (О) посредством двух 2s-электронов (2s2) связан с двумя атомами водорода (Н; 1s1). Угол между связями О и Н равен 180°.То есть Н2О – структура линейная.
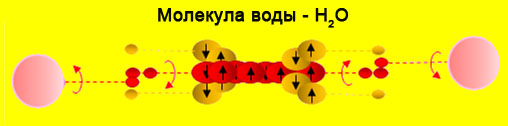
Между собой молекулы Н2О способны соединяться водородными связями, образуя цепочки.

В молекуле Н2S атом S связан с двумя атомами водорода (Н) по тому же принципу – посредством двух s-электронов (3s2).

Но так как атом S (в отличие от атома О) – структура стабильно асимметричная, то водородные связи между молекулами Н2S окажутся непрочными. Поэтому молекула Н2S будет находиться в свободном хаотическом движении.
То есть, всегда cледует помнить, что основой стабильности атома является симметрия его конструкции.
© А. Селас. Сентябрь 2021
