Как известно, свой ства p-элементов второго периода совершенно не похожи на свойства их аналогов третьего и последующего периодов. Попытаемся понять, на чем это отличие основано. Естественно, что речь идет об атомах полярных…
ства p-элементов второго периода совершенно не похожи на свойства их аналогов третьего и последующего периодов. Попытаемся понять, на чем это отличие основано. Естественно, что речь идет об атомах полярных…
Прежде всего, озвучим два условия, лежащих в основе формирования атомов:
- Так как осевое вращение является природным свойством всех элементарных частиц, то при формировании атомов это условие должно сохраняться.
- Несмотря на то, что полярные атомы являются симметрично-асимметричной конструкцией, в основе их стабильности лежит стремление атомов к симметрии, а значит, к стабильности.
Атомы элементов 2 периода
Во 2 периоде к s-элементам относятся литий (Li) и бериллий (Ве).
Следовательно, у этих элементов на s- орбите происходит формирование центральной s- орбитали, которая фактически представляет собой две (смещенные друг относительно друга) вертикали – из протонов и нейтронов, взаимодействующих подобно шестеренкам в зубчатом зацеплении
Атом Li (1s2, 2s1) возникнет, когда к ядру предыдущего элемента – Не, состоящего из двух дейтронов, присоединится третий дейтрон, следствием чего станет появление в вихревой воронке электромагнитного поля протона нового 2s1 электрона.


Исходя из стремления атомов к симметрии, а значит, к стабильности, надстройка ядра атома бериллия Ве (1s2, 2s2), состоящего из 4 дейтронов, произойдет с противоположной (нейтронной) стороны. С этой же стороны в вихревой воронке электромагнитного поля нейтрона появится новый 2s1 электрон.
Поскольку «сигарообразный» изотоп 8Ве является нестабильным (не жизнеспособным), у следующего атома – бора (В) удлинение остова ядра лишено смысла.
Р-элементы 2 периода
Во 2 периоде р-элементами являются: бор (В), углерод (С), азот (N), кислород (О), фтор (F), неон (Ne).
Отличительная черта р-элементов – наличие в их атомах p-орбиталей. Естественно, что процесс формирования p-орбиталей начинается с атомного ядра. По сути дела p-орбитали – это ответвление дейтронов от центрального остова ядра.
И тут в озникает вопрос: а каким же образом дейтроны смогут подойти к ядру, минуя тако
озникает вопрос: а каким же образом дейтроны смогут подойти к ядру, минуя тако е препятствие, как окружающееющее ядро электромагнитное поле?
е препятствие, как окружающееющее ядро электромагнитное поле?
Все очень просто. Так как нуклоны состоят из положительных и отрицательных кварков (монополей), то в атомных ядрах их электромагнитные поля друг друга нейтрализуют. Исключением станут два положительных полюса атома – протонный и нейтронный.
А это означает, что:
средняя часть ядра любого атома практически
окажется свободной от электромагнитной оболочки,
что и обеспечит подход дейтронов к атомному ядру
Наглядно это показано на схемах ядер атомов гелия (Не) и бериллия (Ве), где положительные и отрицательные кварки и их электромагнитные поля условно расцвечены, соответственно, красным и синим цветами.
У атома бора В (1s2, 2s2 ,2р1) одна дейтронная p-орбиталь, и, соответственно, одна электронная р-орбиталь. Естественно, что единственная дейтронная p-орбиталь атома бора (В) никак не зафиксирована и в пределах 180о способна перемещаться по p-орбите.
 У атома углерода С (1s2, 2s2 ,2р2) две дейтронных p-орбитали и, соответственно, две электронные р-орбитали.
У атома углерода С (1s2, 2s2 ,2р2) две дейтронных p-орбитали и, соответственно, две электронные р-орбитали.
Причем, исходя из условия симметрии, вторая дейтронная p-орбиталь у атома углерода (С) появилась на противоположной (верхней) стороне остова ядра. Причем, обе дейтронные p-орбитали могут (в пределах 180о) свободно перемещаться по p-орбитам.
пределах 180о) свободно перемещаться по p-орбитам.
У атома азота N (1s2, 2s2, 2р3) на нижней части ядра располагаются две дейтронные p-орбитали. Причем, каждая из этих двух p-орбиталей способна менять свое положение, перемещаясь (в пределах 180о) вокруг протонной вертикали ядра. Но поскольку неоправданная асимметрия атомам чужда, то наиболее вероятно, что две р-орбитали разместятся симметрично под углом ≥ 90о.
Естественно, что двум нижним дейтронным р-орбиталям будут соответствовать две p-орбитали электронные.
Атом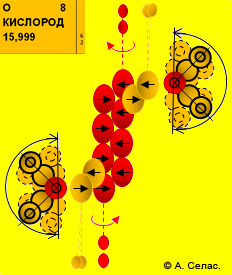 кислорода О (1s2, 2s2, 2р4) – конструкция «условно говоря» симметричная, которая создается симметричным расположением двух нижних и двух верхних дейтронных p-орбиталей. Причем, каждая из этих четырех дейтронных p-орбиталей вольна (в пределах 180о) перемещаться по p-орбите. Хотя, наиболее вероятно, что на верхней и нижней р-орбитах р-орбитали разместятся симметрично под углом ≥ 90о.
кислорода О (1s2, 2s2, 2р4) – конструкция «условно говоря» симметричная, которая создается симметричным расположением двух нижних и двух верхних дейтронных p-орбиталей. Причем, каждая из этих четырех дейтронных p-орбиталей вольна (в пределах 180о) перемещаться по p-орбите. Хотя, наиболее вероятно, что на верхней и нижней р-орбитах р-орбитали разместятся симметрично под углом ≥ 90о.
В атоме кислорода (О) четырем дейтронным р-орбиталям будут соответствовать четыре p- орбитали электронные.
орбитали электронные.
У атома фтора F (1s2, 2s2, 2р5) на нижней (протонной) части остова ядра расположены три (3) дейтронные p-орбитали, которым соответствуют три p-орбитали электронные.
 Из схемы видно, что на р-орбитах не могут располагаться более 3-х дейтронных p-орбиталей. Ведь в атомных ядрах нуклоны должны вращаться, не мешая друг другу.
Из схемы видно, что на р-орбитах не могут располагаться более 3-х дейтронных p-орбиталей. Ведь в атомных ядрах нуклоны должны вращаться, не мешая друг другу.
У атома неона Nе (1s2, 2s2, 2р6) дейтроны сформировали все шесть p-орбиталей. Три p-орбитали отходят от протонной вертикали ядра и три – от нейтронной. Им соответствуют шесть р-орбиталей электронных
Выводы:
Процесс формирования атомов 2 периода фактически раскрывает схему построения атомов 3 – 7 периодов.
1. Сигарообразный остов ядра (дейтронная s- орбиталь), с которого началось строительство простейших атомов Li и Ве – это, по сути дела, «площадка» для формирования дейтронных р-орбиталей. Именно поэтому в каждом из периодов строительство атомов начинается с наращивания остова ядра - s- орбитали.
- s- орбитали.
2. Ограничение числа р-орбиталей до трех (на верхней и нижней р-орбитах) обусловлено необходимостью сохранения осевого вращения нуклонов.
3. Исходя из того, что в основе строительства атомов лежит их стремление к стабильности (а значит, к симметрии), формирование р-орбиталей происходит поочередно: низ – верх атома.
4. Уникальность элементов 2-го периода заключается в том, что у р-элементов: В, С, N, O, F дейтронные р- орбитали могут менять свое положение, перемещаться по р-орбите.
5. Стабильный «каркас» из шести дейтронных р-орбиталей (трех верхних и трех нижних) сформировавшейся в атоме последнего элемента 2-го периода – неона (Ne), станет матрицей, в соответствии с которой атомы элементов 3-7 периодов начнут строить свои дейтронные р-орбитали.
© А. Селас. Май 2015 – Июль 2021
